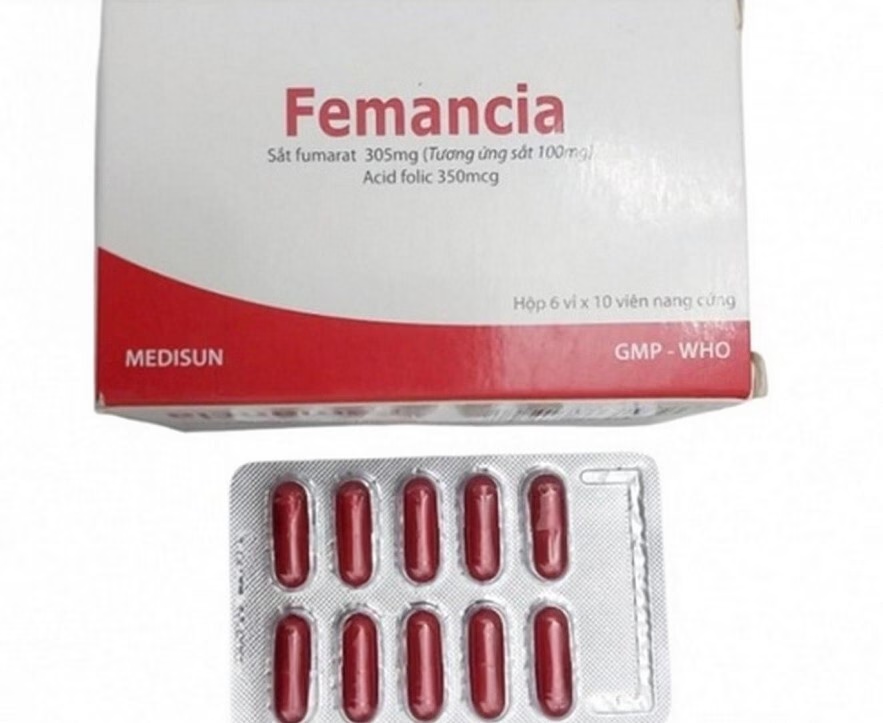
Cục Quản lý dược, Bộ Y tế, vừa ra thông báo ngừng tiếp nhận hồ sơ đề nghị cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với Công ty CP Dược phẩm Me Di Sun. Quyết định này có hiệu lực trong 12 tháng kể từ ngày 30/7.
Quyết định này được đưa ra sau khi Công ty CP Dược phẩm Me Di Sun sản xuất 2 lô thuốc vi phạm chất lượng mức độ 2. Trước đó, Cục Quản lý dược đã có văn bản thông báo thu hồi bắt buộc toàn bộ các lô thuốc Femancia do công ty này sản xuất.
Thuốc Femancia là viên nang cứng chứa sắt nguyên tố và Acid Folic, được chỉ định trong các trường hợp thiếu máu do thiếu sắt hoặc thiếu hụt acid folic. Theo Cục Quản lý dược, việc thu hồi thuốc Femancia được thực hiện theo quy định tại Luật Dược 2016.
Công ty CP Dược phẩm Me Di Sun phải phối hợp với nhà phân phối thuốc để tổ chức việc thu hồi toàn bộ thuốc Femancia trong vòng 15 ngày. Đồng thời, công ty này cũng phải thực hiện việc thông báo cho các khách hàng, nhà phân phối về việc thu hồi toàn bộ các lô thuốc Femancia.
Như vậy, với quyết định ngừng tiếp nhận hồ sơ đề nghị cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, Công ty CP Dược phẩm Me Di Sun sẽ không được tiếp nhận hồ sơ đề nghị cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc trong thời gian 12 tháng kể từ ngày 30/7.
Trong thời gian này, công ty này phải tập trung vào việc thu hồi toàn bộ thuốc Femancia và khắc phục các vi phạm về chất lượng thuốc. Việc này nhằm đảm bảo an toàn cho người bệnh và uy tín của công ty.